《合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告》(2014年第43号)
2、申请表填写实现并凯旋提交后,打印纸质版,随其他材料一同报送受理核心。
4、新产物需求递交一份纸质版复印件、复印件和原件划一性声明,电子版存档材料。
境表:上市阐明及企业资历阐明文献、代办委托书、代办人允诺书及天分阐明文献。
申报产物的满堂性描摹,囊括产物构成、感化机理、合用鸿沟、型号规格、包装等。
为确保产物的太平有用而实行的一系列考虑,其联系试验数据及材料的汇总,囊括产物本能考虑、生物相容性评议、太平性考虑、灭菌/消毒工艺考虑、产物有用期和包装考虑、临床前动物试验、软件考虑等。
产物临蓐筑设历程的描摹,可采用流程图的地势,囊括要害工艺和迥殊工艺的注脚等。
产物临床利用太平有用的阐明性材料,能够是临床试验,也能够是同种类比对等其他材料。
产物危险剖析材料是对产物的危险约束历程及其评审的结果予以纪录所酿成的材料,囊括危险剖析、危险评议、危险驾驭步骤的执行和验证结果以及盈利危险评定等。
详见《合于颁布医疗东西产物技巧请求编写诱导规矩的宣布》(2014年第9号)。
详见《医疗东西仿单和标签约束规则》(国度食物药品监视约束总局令第6号)。
产物是否相符国标/行标的请求的声明、申请人/注册人提交的原料真正性的声明。
代办人:向我国境内出口医疗东西的境表临蓐企业正在我国境内设立的代表机构或者指定的我国境内的企业法人称为代办人。
注册代办:是指帮帮申请人/注册人处置注册联系事宜的办事机构,与代办人没有必定的相合。
国度食物药品监视约束总局合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告(2014年第43号)
合于颁布体表诊断试剂注册申报材料请乞降接受阐明文献款式的布告(2014年第44号)
讨论的鸿沟苛重是医疗东西注册申报前的联系题目,不包罗技巧审评历程中的联系题目。
每周五下昼1:00至4:00,北京市西城区宣武门西大街大成广场行政受理办事大厅。
境内申请人带领:申请人出具的涵盖联系委托实质的委托书、部分有用身份证件、医疗东西技巧审评核心讨论立案表。
境表申请人带领:境表申请人指定境内企业法人行为代办人的委托书、境内代办人出具的涵盖联系委托实质的委托书、部分有用身份证件、医疗东西技巧审评核心讨论立案表。
先依照《合于启用总局行政受理办事大厅上预定受理体例的布告》(第192号)的请求实行用户注册。
可正在逐日7:00至23:00登录预定体例的东西受理前讨论(一)、(二)、(三)端口,依照属意事项中相合请求实行预定,填写并上传医疗东西技巧审评核心讨论立案表(最多填写5个讨论题目且讨论题目应相符相应讨论部分的职责鸿沟)。
如未预定或未预定凯旋,可按联系请求现场取号,领取并填写、提交医疗东西技巧审评核心讨论立案表(最多填写5个讨论题目且讨论题目应相符相应讨论部分的职责鸿沟),守候核心以电子邮件的格式实行答复。
核心会按期颁布宣布,颁布实在讨论事务的陈设。行政相对人须依照核心颁布的讨论陈设,遴选相应审评部分预定讨论。
合于医疗东西注册受理前技巧题目讨论事务相合事项的宣布(2018年第4号)
合于通过上预定地势展开医疗东西注册受理前技巧题目讨论事务的布告(2017年第4号)
第一类危险水准低,实行向例约束能够包管其太平、有用的医疗东西。仅需注册约束。
第二类拥有中度危险,需求肃穆驾驭约束以包管其太平、有用的医疗东西。需求申报注册。
第三类拥有较高危险,需求选取特地步骤肃穆驾驭约束以包管其太平、有用的医疗东西。需求申报注册。
可直接按第三类医疗东西产物申报,器审核心凭据申报产物的实践处境判决种别。
属于改进、优先或药械组合的产物正在处置进入相应流程后,可随即实行产物种别判决。
新版《医疗东西分类目次》自2018年8月1日先导执行,请凭据联系请求实行分类事务。
总局办公厅合于模范医疗东西产物分类相合事务的通告(食药监办械管〔2017〕127号)
总局合于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体表诊断试剂产物属性及种别调剂的宣布(2017年第226号)
食物药品囚禁总局合于印发体表诊断试剂分类子目次的通告(食药监械管〔2013〕242号)
规矩:注册检修该当正在拥有医疗东西检修天分、且检修项目正在其承检鸿沟内的检修机构实行。
可进入器审核心站,正在右下方运动栏点击检测核心承检目次库,输入检索产物名称或机构名称,点击盘查。
A1:尚未列入承检鸿沟的医疗东西,由相应的注册审批部分指定有材干的检修机构实行检修;或申请人可向国度药品监视约束局东西注册司提交由有检修材干的检修机构实行检修的申请, 获得批复后,可按批复实质实行。
A2:统一注册单位内所检修的产物该当可能代表本注册单位内其他产物的太平性和有用性。
A3:已通过改进医疗东西特地审批申请的境内医疗东西,样品可委托拥有相应临蓐鸿沟的医疗东西临蓐企业临蓐;不属于依照医疗东西特地审批申请的境内医疗东西申请注册时,样品不得委托其他企业临蓐。
医疗东西临床评议是指申请人通过临床文件材料、临床履历数据、临床试验等音信对产物是否餍足利用请求或合用鸿沟实行确认的历程。
看待列入《免于实行临床试验的医疗东西目次》(以下简称《目次》)的产物,需提交《目次》所述实质的比拟材料和与已获准境内注册的《目次》中医疗东西的比拟注脚。
可实行同种类比对:申请人通过同类已上市医疗东西临床试验或临床利用得到的数据实行剖析,阐明两者根基等同。
可供应临床试验联系材料:正在具备相应要求的临床试验机构中, 对拟申请注册的医疗东西正在寻常利用要求下的太平有用性实行确认。
第三类医疗东西实行临床试验对人体拥有较高危险的,该当经国务院药品监视约束部分接受。
列入《需实行临床试验审批的第三类医疗东西目次》中的医疗东西该当正在中国境内实行临床试验。
列入《免于实行临床试验的医疗东西目次》(以下简称《目次》)的医疗东西产物,可省得于实行临床试验。实在产物可登录国度药品监视约束局站盘查。
与同类已上市产物实行比对,通过临床数据搜求及剖析评议等材料阐明两者根基等同。
申报产物与同种类医疗东西的差别错误产物的太平、有用性发作倒霉影响,可视为根基等同。
(4) 临床评议讲述:临床评议实现后需撰写临床评议讲述,正在注册申请时行为临床评议材料提交。
正在具备相应要求的临床试验机构中, 对拟申请注册的医疗东西正在寻常利用要求下的太平有用性实行确认的历程。
对人体拥有较高危险的第三类医疗东西实行临床试验应得到国务院药品监视约束部分接受。
国度食物药品监视约束总局合于颁布需实行临床试验审批的第三类医疗东西目次的宣布(2014年第14号)
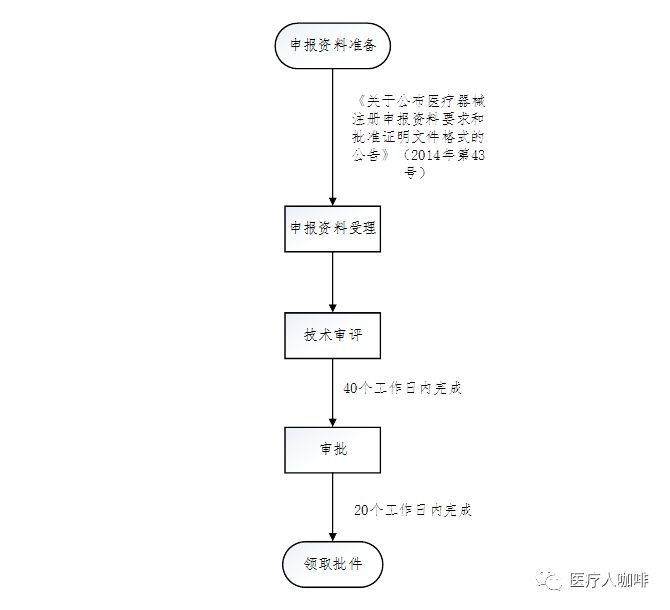
合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告(2014年第43号)
医疗东西临床试验质料约束模范(国度食物药品监视约束总局 中华群多共和国国度卫生和筹划生育委员会令第25号)
国度食物药品监视约束总局合于颁布需实行临床试验审批的第三类医疗东西目次的宣布(2014年第14号)
无源植入性医疗东西临床试验审批申报材料编写诱导规矩(2018年第40号)
总局合于需审批的医疗东西临床试验申请疏导调换相合事项的宣布(2017年第184号)
申请人历程其技巧改进运动,正在中国依法具有产物主旨技巧出现专利权,或者依法通过受让得到正在中国出现专利权或其利用权;或者主旨技巧出现专利的申请已由国务院专利行政部分公然。
产物苛重事务道理/感化机理为国内创始,产物本能或者太平性与同类产物斗劲有根蒂性改良,技巧上处于国际当先程度,而且拥有明显的临床利用价钱。
申请人已实现产物的前期考虑并拥有根基定型产物,考虑历程真正和受控,考虑数据无缺和可溯源。
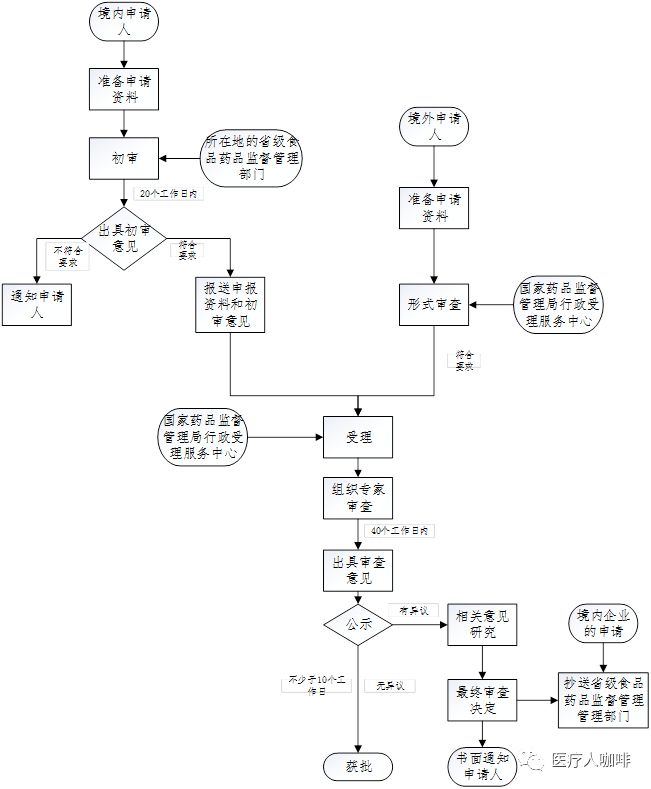
改进医疗东西特地审批的申请仅合用于初度注册产物,分歧用于延续注册和许可事项更改。
食物药品囚禁总局合于印发改进医疗东西特地审批圭表(试行)的通告(食药监械管〔2014〕13号)
总局合于颁布改进医疗东西特地审批申报材料编写指南的宣布(2016年第166号)
境内第三类、进口医疗东西产物的技巧审评;国产第三类、进口医疗东西许可事项更改和延续注册的行政审批、第三类高危险医疗东西临床试验审批肯定。
器审核心站颁布了各部分机能与职员名单,简单企业正在发补时间答疑解惑,按需预定讨论。

改进、境内初度、有庞大转变或者机理不明的医疗东西,器审核心会酌情召开专家讨论会。
通过国度药监局站盘查审评审批进度时,处置状况有以下几种: 正在审评、自行撤回、正在审批、中止审查、审批完毕—待造证、造证完毕—待发批件、造证完毕—守候交回旧证、造证完毕—已发批件。
工夫:事务日(上午:9:00—11:30 ,下昼:13:00—16:00),周三、五下昼错误表办公。
处所:行政受理办事大厅(北京市西城区宣武门西大街28号大成广场3门1层)。
申请人(与申请表盖印单元划一)对委托劳动职员及所劳动项的委托书(见合于处置受理和领取批件等行政许可事项的布告(第169号)(附件1))。
站注册:登录(国度药品监视约束局行政受理办事大厅上预定受理体例),如无账号需进步行注册。联系操作可参考合于启用总局行政受理办事大厅上预定受理体例的布告(第192号)。
预定受理:可正在逐日7:00至23:00登录约体例实行预定,也可不实行上预定,直接前去大厅处置,但上预定的优先处置。
受理:若材料相符请求(实在请求详见:注册申报材料预备),将由器审核心正式受理,并发放受理通告单及缴费通告书;若不相符请求,材料将被退回,并发放补正材料通告书或不予受理通告书。
可申报事项及相应缴费法式可盘查:国度食物药品监视约束总局合于颁布药品、医疗东西产物注册收费法式的布告(2015年第53号)
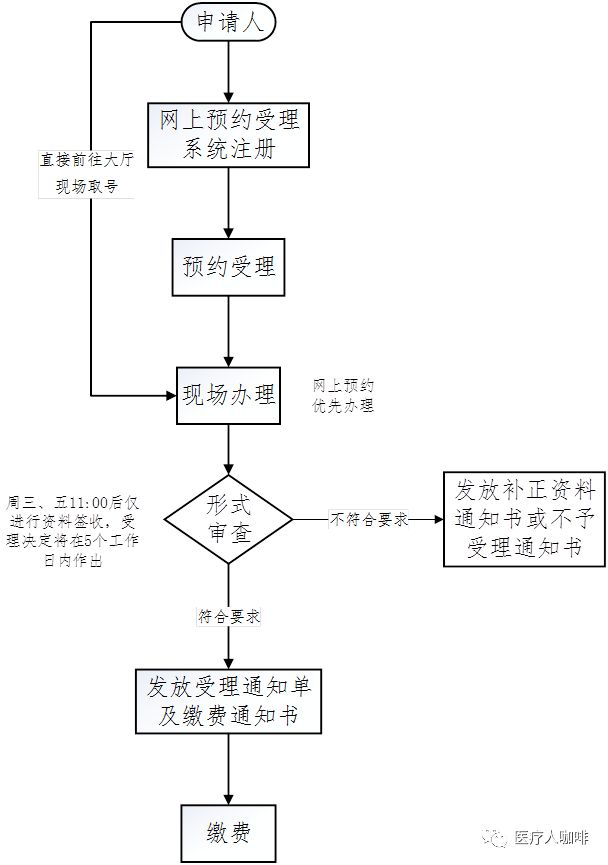
周一、二、四15:30后,周三、五11:00后,将仅实行材料签收,不做现场材料审查。
国度食物药品监视约束总局合于颁布药品、医疗东西产物注册收费法式的布告(2015年第53号)
(3) 诊断或者疗养暮年人特有和多发疾病,且目前尚无有用诊断或者疗养本领;
看待其他该当优先审批的医疗东西,由国度药品监视约束局通常听取定见,并机合专家论证后再确定是否予以优先审批。
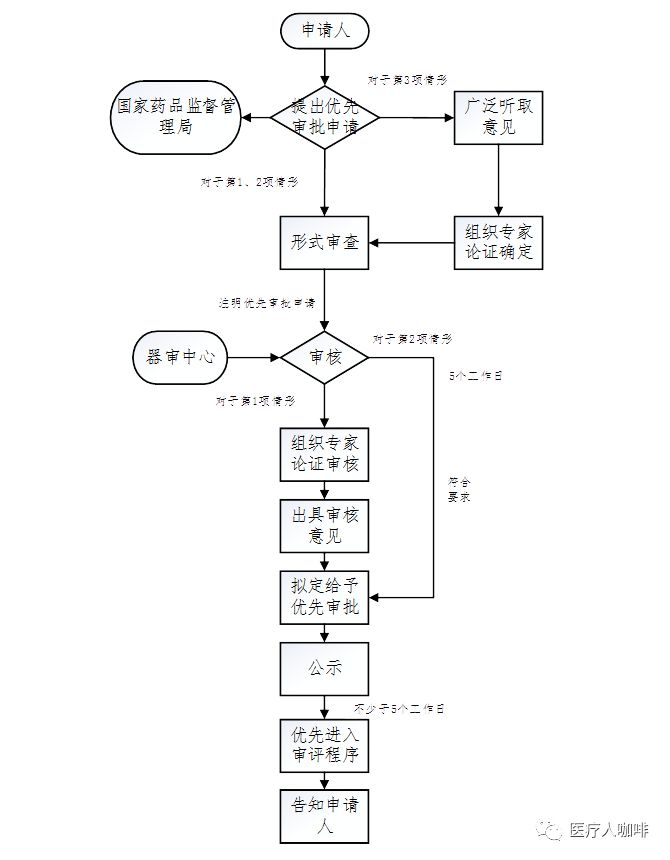
对公示项目有反驳的,器审核心正在收到反驳起10个事务日内,对子系定见实行考虑,并将考虑定见示知申请人和提出反驳方。
器审核心经审核不予优先审批的,将不予优先审批的定见和起因示知申请人,并按向例审批圭表处置。
总局合于颁布医疗东西优先审批申报材料编写指南(试行)的宣布(2017年第28号)
正在注册审评历程中,当申请人/注册人所提交的注册材料不行餍足联系请求时,需求申请人/注册人提交所罅漏部门的材料。主审将一次性示知申请人/注册人所需添补的材料,并将补正材料通告单寄送给申请人/注册人。
申请人/注册人正在收到补正材料通告后,该当正在1年内以书面地势一次性将添补材料送至核心。未能正在规则时限内添补材料,体例将主动终止技巧审评。
添补材料首页附《补正材料通告单》复印件,后顺次为《添补材料实质注脚》、添补材料目次、实在补填塞质。每项补填塞质利用隔页纸分裂,并按补正材料通告请求的秩序同一编码收拾。
补正材料预审查圭表是相应审评职员对拟提交的添补材料实行预审查并书面反应申请人/注册人的讨论格式。
医疗东西技巧审评核心正在医疗东西注册审评事务中,对需求讨论的技巧题目请讨论专家以聚会的地势实行接洽并提出定见的历程。
虽已有同类产物正在境内上市,但因原料、组织、道理、合用鸿沟、适合症产生庞大转变,现有审评凭据、履历无法有用驾御的医疗东西
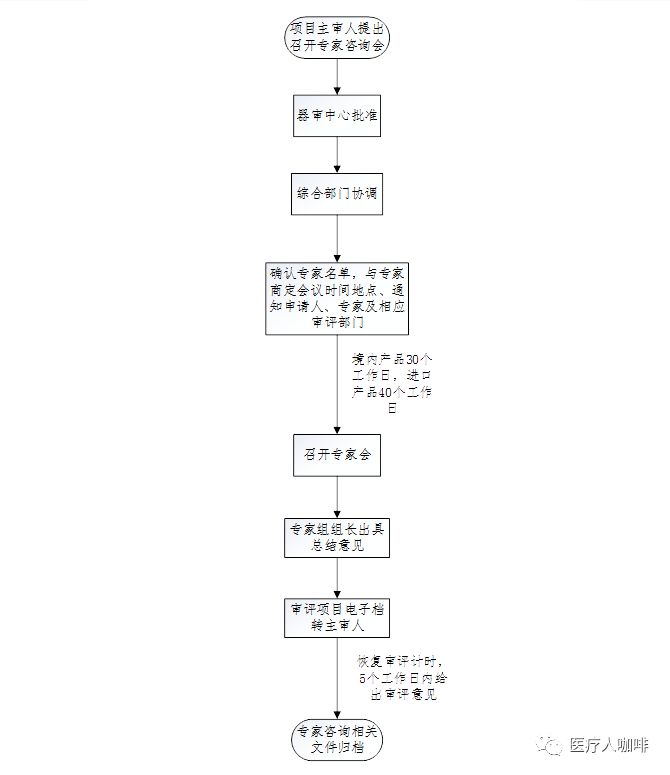
A1:由器审核心凭据《医疗东西技巧审评核心专家讨论会/专家公然论证会操作模范》附3《专家抉择操作规程》从相应专家库入抉择。
A2:申请人及研发专家可插足现场答辩;可申请回避有优点联系的专家;可申请回避日期;
申请人正在收到提交专家讨论会材料的通告后,10个事务日内将回执寄到器审核心,之后于20个事务日内按
合于印发医疗东西技巧审评核心专家讨论会/专家公然论证会操作模范的通告(食药监械审〔2017〕21号)
苛重针对处于发补状况的医疗东西注册项目。申请人或注册人正在补回材料前,与主审针对补正材料通告单联系实质实行疏导和答疑。
每周四9:00—11:30、13:30—16:30遵照预定工夫准时到核心折务大厅实行讨论。
每个相符请求的受理号申请现场讨论的时机规矩上不逾越3次。如逾期未废除预定,则现场讨论的时机裁汰 1 次。
持补正材料通告单复印件、《补正材料预审考究事申请单》和拟提交预审查的添补材料,交至核心营业大厅(北京市海淀区气候道50号院1号楼一层)。
1、领取处所:行政受理办事大厅(北京市西城区宣武门西大街28号大成广场3门1层)
申请人(与申请表盖印单元划一)对委托劳动职员及所劳动项的委托书(见合于处置受理和领取批件等行政许可事项的布告(第169号)附件2)
造证实现后3个事务日内未领取的批件将由办事大厅联系事务职员同一邮寄,并颁布寄件音信。
邮寄音信盘查:进入国度药品监视约束局劳动办事版块——正在投递音信页面——遴选医疗东西分类,查看医疗东西批件邮寄详情单,可凭据颁布的EMS号到11185站盘查邮寄处境。
盘查延续注册项目注册证号和接受日期:登录器审核心站劳动大厅栏目,正在审评进度盘查栏中,通过输入受理号、受理日期、申请单元、数据校验码等音信盘查。
国度食物药品监视约束总局合于颁布医疗东西注册证补办圭表等5个联系事务圭表的宣布(2015年第91号)
已注册的第二类、第三类医疗东西,医疗东西注册证及其附件载明的实质产生蜕化,注册人该当向原注册部分申请注册更改,并按拍照合请求提交申报材料。
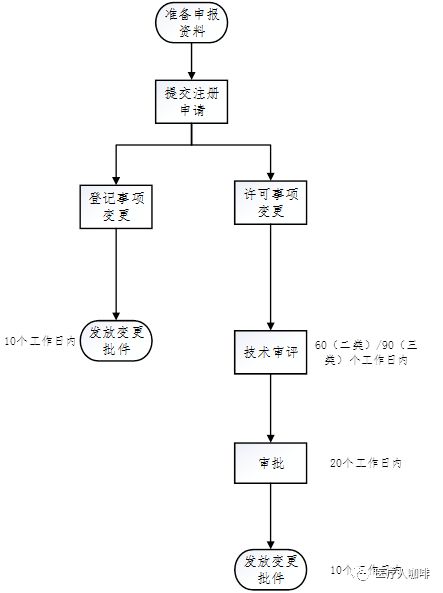
医疗东西注册更改文献与原医疗东西注册证兼并利用,其有用期与该注册证类似。
得到注册更改文献后,注册人该当凭据更改实质自行修削产物技巧请求、仿单和标签。
合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告(2014年第43号)
申请人该当正在医疗东西注册证有用期届满6个月前,向食物药品监视约束部分申请延续注册,并按拍照合请求提交申报材料。
医疗东西强造性法式依然修订(或者看待体表诊断试剂产物有新的国度法式品、参考品),该医疗东西/体表诊断试剂不行到达新请求;
对用于疗养罕见疾病以及应对突发群多卫生事变急需的医疗东西,接受注册部分正在接受上市时提出请求,申请人未正在规则刻日内实现医疗东西注册证载明事项。
向原注册部分申请延续注册,参考《合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告》(2014年第43号)联系请求提交申报材料。
材料经地势审查并受理后,需由技巧审评机构中心针对蜕化部门实行审评,并于60(第二类)/90(第三类)个事务日内实现技巧审评事务,若需添补材料的境况参见发补)。
盘查延续注册项目注册证号和接受日期:登录器审核心站劳动大厅栏目,正在审评进度盘查栏中,通过输入受理号、受理日期、申请单元、数据校验码等音信盘查。
原医疗东西注册证中载明请求接续实现事务的,应正在注册证有用期内产物剖析讲述中供应联系总结讲述,并附相应材料。
合于颁布医疗东西注册申报材料请乞降接受阐明文献款式的布告(2014年第43号)
国度药品监视约束局合于修削医疗东西延续注册等部门申报材料请求的布告(2018年第53号)
已注册医疗东西的仿单的实质(除注册证及其附件载明事项除表的其他实质)产生蜕化,且蜕化实质不属于许可事项更改 (如有用期/合用鸿沟/型号规格等) 鸿沟内的处境需向医疗东西注册的审批部分书面示知。

进入国度药品监视约束局劳动办事版块,正在投递音信页面查看仿单不予应许通告件颁布通告。




支付宝转账赞助
支付宝扫一扫赞助
微信转账赞助
微信扫一扫赞助